
余浩群 2006年进入亿博检测技术有限公司,担任高级技术顾问。
精通各类检测认证标准,服务过上千家企业。 联系方式:13824328299(微信同号) 座机:0755-29451282 传真:0755-22639141
邮箱:ebo@ebotek.cn
地址:深圳市宝安新安六路勤业商务中心A栋一楼112-114
 扫一扫加顾问微信
扫一扫加顾问微信
 扫码咨询
扫码咨询
亿博第三方检测机构,具有第三方公正地位的独立检验机构, 已有超过十年的检测认证经验, 拥有资深的工程师队伍,专业的技术团队,服务热线:138-2432-8299
FDA 510(k)申请方式
传统审核-适用于新器械,申请时需递交适用的性能报告。
特殊审核-适用于依照设计控制程序作了较小改动的器械。
简化审核-由制造商提交,制造商必须确保并声明其产品符合现有FDA认可的标准。
不同510(k)申请要求
传统510(k)
包含21 CFR中规定的510(k)的所有要素,在90天内审核。
特殊510(k)
1)申请人对其合法销售器械进行了重大改动;
2)申请人认为需要进行新的510(k)申请;
3)这些改动不影响器械的预期用途或基本科学技术;
4)申请人按照21CFR中设计控制的要求对改动进行评估;
5)申请人递交510(k)申请的同时,也递交符合设计控制原则的声明;
6)在30天内审核。
简略510(k)
1)申请人递交新器械的510(k)申请;
2)器械适用特殊控制规定:指导性文件或公认标准;
3)申请人遵从指导性文件和/或公认标准;
4)包含21CFR中规定的510(k)的所有要素;
5)递交510(k)申请时,同时递交遵从指导性文件或公认标准的总结信息;
6)在90天内审核。
FDA 510(k)申请流程图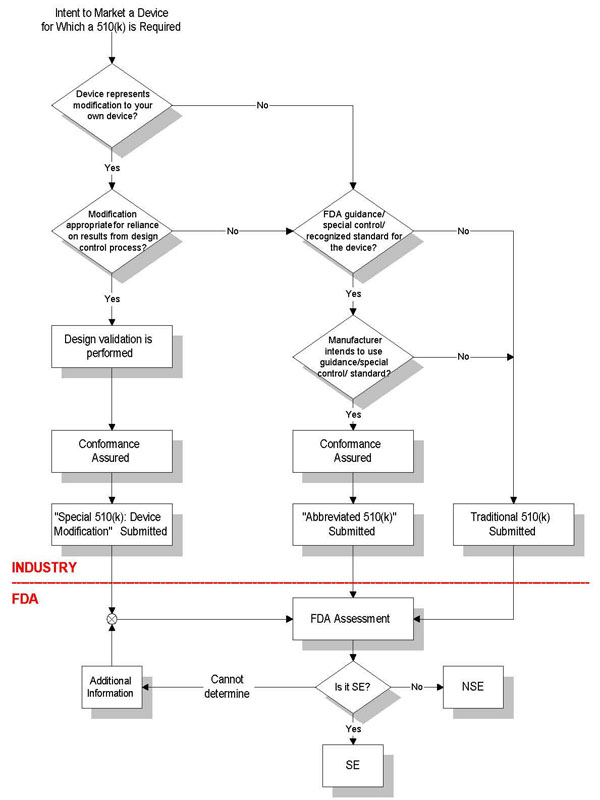

余浩群 2006年进入亿博检测技术有限公司,担任高级技术顾问。
精通各类检测认证标准,服务过上千家企业。 联系方式:13824328299(微信同号) 座机:0755-29451282 传真:0755-22639141
邮箱:ebo@ebotek.cn
地址:深圳市宝安新安六路勤业商务中心A栋一楼112-114
 扫一扫加顾问微信
扫一扫加顾问微信